ОГЛАВЛЕНИЕ
Благодаря действующим веществам ноотропные препараты блокируют факторы, которые могут повлиять на повреждение тканей глаза. Также нейропротекция улучшает функционирование всего организма, благодаря укреплению нервных тканей. Нейропротекция при глаукоме заключается в создании защиты для сетчатки глаза и зрительных нервов.
Для уверенности в положительном влиянии ноотропов на нервную систему, было проведено массы исследований, практически каждое из которых подтвердило позитивное воздействие на психоэмоциональное состояние человека.
Поэтому подбор и приём одновременно нескольких препаратов с нейропротекторными свойствами может существенно снизить темпы развития глаукомы, а также благотворно скажется на общем самочувствии.
Нейропротекторная терапия при глаукоме

Нейропротекторы непрямого действия, влияя на различные патофизиологические нарушения (снижение перфузионного давления, атеросклероз, изменение реологических свойств крови, ангиоспазм) и повышая устойчивость различных функциональных систем к снижению перфузионного давления кислорода в тканях, опосредованно оказывают защитное действие.
Подобным эффектом обладают препараты, улучшающие микроциркуляцию, реологические свойства крови, снижающие уровень холестерина в крови, ноотропные средства. Нейропротекторная терапия должна всегда проводиться при активном гипотензивном лечении (медикаментозном, лазерном или хирургическом), позволяющем достичь целевого давления.
Следует отметить, что классификация препаратов по характеру нейропротекторного действия при глаукоме весьма условна, т.к. далеко не все механизмы воздействия хорошо изучены, да и сам механизм апоптоза ганглиозных клеток сетчатки при глаукоме во многом базируется на теоретических предположениях.
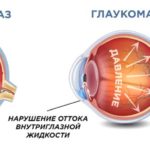
Снижение уровня ВГД для предотвращения дальнейшего необратимого прогрессирования нарушения зрительных функций. Достижение «давления цели» (в среднем понижение уровня ВГД на 20-30% от исходного). При этом, чем больший ущерб нанесен состоянию зрительного нерва, тем ниже должен быть уровень «давления цели».
Необходим регулярный контроль соответствия тонометрического давления «давлению цели». Верхняя граница желаемого офтальмотонуса соответствует:
- при начальной стадии истинное ВГД (Р0) 18-20 мм рт. ст. (тонометрическое ВГД (Pt) 22-24 мм рт.ст.);
- при развитой стадии истинное ВГД (Р0) 15-17 мм рт.ст. (тонометрическое ВГД (Pt) 19-21 мм рт.ст.);
- при далеко зашедшей стадии истинное ВГД (Р0) 10-14 мм рт.ст. (тонометрическое ВГД (Pt) 16-18 мм рт.ст.).
Медикаментозное лечение должно быть эффективным и достаточным для того, чтобы уверенно контролировать уровень ВГД. При этом следует помнить о так называемом эффекте тахифилаксии (т.е. привыкании к лекарственным препаратам) и необходимости своевременной коррекции проводимой терапии при выявлении малейших признаков субкомпенсации ВГД.
На российском фармацевтическом рынке присутствуют практически все фармакологические группы антиглаукоматозных препаратов, получившие распространение в мире. В этой связи врач имеет возможность патогенетически обоснованного выбора препарата, основываясь при этом, в первую очередь, на данных о его клинической эффективности.
Постоянно имея в виду необходимость достижения эффективного лечения и имея возможность выбора препарата, следует обращать внимание на так называемый критерий «стоимость-эффективность».
Этот критерий позволяет учесть и соотнести расходы и эффективность назначенной терапии. Нередко изначально более дорогие препараты являются, в конечном итоге, более выгодными для пациентов, в том числе и из-за более эффективного и контролируемого понижения уровня ВГД.
Общие принципы выбора лекарственной гипотензивной терапии:
- До лечения определяют предполагаемое «давление цели» с учетом всех факторов риска, имеющихся у данного конкретного больного.
- Лечение начинают с монотерапии лекарственным средством (ЛС) первого выбора. При его недостаточной эффективности данное ЛС заменяют другим ЛС из другой фармакологической группы, если и в этом случае не удается достичь адекватного снижения ВГД, то переходят к комбинированной терапии.
- При непереносимости или наличии противопоказаний к применению выбранного ЛС лечение начинают с использования другого ЛС.
- При проведении комбинированной терапии не следует использовать более двух ЛС одновременно; предпочтительно применение комбинированных ЛС.
- При проведении комбинированной терапии не следует использовать ЛС, относящиеся к одной и той же фармакологической группе (например, нельзя комбинировать два разных b-блокатора или два разных простагландина).
- Адекватность достигнутого гипотензивного эффекта регулярно проверяется динамикой зрительных функций и состоянием диска зрительного нерва.
- При оценке лекарственного воздействия необходимо учитывать следующее:
- тип влияния на гидродинамику глаза;
- степень возможного снижения ВГД;
- противопоказания к применению;
- переносимость;
- необходимую частоту применения.
- При выборе ЛС необходимо систематическое сравнение полученного тонометрического давления с «давлением цели». ВГД не должно быть выше «давления цели».
- Лечение осуществляется на протяжении всей жизни больного. При проведении медикаментозной терапии целесообразно менять ЛС. С этой целью 2-3 раза в год на 1 месяц изменяют терапию, за исключением терапии проста-гландинами и ингибиторами карбоангидразы. Замену следует проводить на ЛС, принадлежащее к другой фармакологической группе.
Два последних фактора могут значительно ухудшать качество жизни больных и, в конечном итоге, приводить к несоблюдению рекомендуемого режима лечения, что снижает эффективность проводимой терапии.
Препарат должен:
- эффективно снижать внутриглазное давление;
- поддерживать низкий уровень ВГД с небольшими колебаниями его значений в течение суток;
- сохранять свое гипотензивное действие в течение длительного времени;
- обладать минимумом побочных реакций;
- иметь удобный и простой режим дозирования.
Классификация
Существует четыре степени изменения нервных волокон при глаукоме:
- Безвозвратно погибшие;
- Острая фаза дегенерации;
- Дистрофические изменения;
- Сохранная структура.
Нейропротекторы делят на две группы:
- Прямые непосредственно защищают нейроны и волокна сетчатки и зрительного нерва, соответственно.
- Непрямые нейропротекторы повышают устойчивость организма к снижению реперфузионого давления.
Подбор конкретной противоглаукомной терапии требует от врача системного обследования пациента. Он проводится на основании гемодинамических нарушений, метаболических сдвигов. Контролировать эффективность лечения нужно каждые полгода. Ниже представлены основные группы нейропротекторов.
Блокаторы кальциевых каналов
Препараты этой группы повышают устойчивость клеток к ишемическому воздействию, а также расширяют сосуды. Чаще всего используют бетаксолол. Это лекарство снижает сосудистое сопротивление и повышает устойчивость нейронов.
За счет хорошей проницаемости, активное вещество быстро проникает в структуры глаза и уже в первый час после инстилляции действует на рецепторы. Чтобы снизить уровень давления внутри глаза бетаксолол закапывают дважды в сутки, но иногда кратность увеличивают до 3-4 раз.
Противопоказано назначение этого лекарства пациентам с нарушением работы и ритма сердца, дистрофией роговицы, а также при гиперчуствительности. Пациенты с сахарным диабетом, тиреотоксикозом, мышечной слабостью, синдромом Рейно должны соблюдать осторожность. То же касается и беременных женщин.
Перед плановой общей анестезией желательно отменить препарат. На фоне терапии контролировать состояние глаз (продукция слезной жидкости, целостность эпителия) нужно хотя бы раз в полгода. При местном использовании бетаксолола развитие системных побочных эффектов маловероятно. Препараты, которые содержат бетаксолол в качестве действующего вещества:
- Бетоптик (0,5% раствор);
- Беоптик С (0,25% раствор).
Ферментные антиоксиданты
Супероксиддисмутаза относится к природным антиоксидантным защитникам организма. Он разрушает активные формы кислорода и оказывает противовоспалительное действие. За счет этого тормозится развитие деградации в структурах трабекулярной сети и волокнах зрительного нерва.
Препараты, выпускаемые различными производителями:
- Эрисод. Представляет собой лиофилизированный порошок (400 тысяч и 1,6 миллиона единиц), из которого готовят капли для глаз.
- Рексод (800 тысяч единиц).
Неферментные антиоксиданты
Гистохром может нейтрализовать ионы железа, которые обычно накапливаются в зоне ишемии. Также он перезватывает свободные радикалы, улучшает энергетический обмен и нормализует реологические свойства крови. Максимальная концентрация препарата достигается спустя час после введения. Пути введения лекарства включают субконъюнктивальный и прбульбарный.
Продолжительность курса терапии составляет 10 инъекций. Препарат Гистохром выпускается в виде 0,02% раствора в ампулах. Янтарная кислота положительным образом влияет на метаболические процессы. При этом снижается ионная проницаемость мембраны, регулируется кальциевый обмен и т.д. соли этой кислоты являются составляющими многих БАДов (митомин, янтавит, энерлит).
Сукцинатсодержащие гетероциклические соединения (например, мексидол) являются более перспективными лекарствами. Этот препарат образует буферную окислительно-восстановительную систему. Он положительно влияет на энергетические процессы в клетках, активизирует синтез нуклеиновых кислот, усиливает гликолиз.
Мексидол улучшает кровоток в зоне ишемии и способствует скорейшему заживлению дефектов. Мексидол нельзя назначать при гиперчувствительности или в случае серьезных заболеваний печени и почек. Среди побочных эффектов чаще проявляются диспепсия, сухость во рту и аллергия.
Вводят мексидол внутримышечно (100 мг) дважды в сутки. Курс терапии составляет 10-14 дней. Препарат выпускается в виде 5% раствора.
Эмоксипин является одним из наиболее старых препаратов для лечения заболеваний глаз, сопровождающихся ишемией. Это вещество является структурным аналогом витамина В6. Препарат стабилизирует мембрану эритроцитов, играет важную роль при нарушении микроциркуляции.
Максимальная концентрация наблюдается через 15-30 минут, при этом происходит накопление вещества в клетках сетчатки. При лечении эмоксипином требуется контроль коагулограммы крови. Нельзя смешивать лекарство в одном шприце с другими препаратами. Эффективность лечения повышается, если одновременно внутрь принимать альфа-токоферол.
Эмокипин можно вводить путем инстилляции, приокулярных инъекций или в виде глазной пленки. Кратность закапываний обычно составляет 5-6 аз в сутки. Курс лечения достигает 2-4 недель. Препарат выпускается виде 1% раствора или глазных пленок.
Нейропептиды
Цитомедины представляют собой щелочные полипептиды. Путем кислотной экстракции их очищают от примесей. Эти вещества стимулируют процессы дифференцировки клеток, влиют на гуморальный и клеточный иммунитет, гемостаз, микроциркуляцию. Цитомедины, которые получают из тканей головного мозга, сетчатки, участвуют в регуляции нервной ткани.
Сейчас в офтальмологии применяют кортексин и ретиналамин. Ретиналамин вводят внутримышечно, парабульбарно (один раз в сутки), кортексин вводят только внутримышечно. Курс терапии продолжается 10 суток. Чтобы улучшить гемодинамику, можно использовать ангиопротекторы и спазмолитики.
Спазмолитики
В клинической практике используют пуриновые и индольные алколоиды. Они повышают концентрацию цАМФ в стенке сосудов, угнетают агрегацию тромбоцитов. Обычно назначают Теофиллин (250 мг трижды в сутки) или ксантинола никотинат (150 мг трижды в день).
К индольным алколоидам относят винпоцетин (принимают внутрь по 5 мг трижды в сутки). Для повышения эффективности курс можно начать с внутривенного введения. Пуриновые алколоиды включают курантил, трентал. Они улучшают реологические свойства крови при ежедневном применении.
Ангиопротекторы
Эти лекарства нормализуют микроциркуляцию, сосудистую проницаемость, устранят отеки тканей, связанных с нарушением проницаемости сосудистой стенки, снижают активность плазматических кининов и стимулируют метаболические процессы. В практике используют доксиум, пармидин, этамзилат. Корректировать метаболические нарушения помогают витамины и ноотропы.
Ноотропные средства
Чаще всего из этой группы препаратов назначают пирацетам, который улучшает микроцикуляцию, метаболические процессы и повышает утилизацию глюкозы. Противопоказано назначение препарата при выраженной почечной недостаточности, геморрагическом инсульте, гиперчувствительности. Назначат лекарство внутрь по 30-160 мг/кг/сутки. Курс терапии составляет 6-8 недель.
Также в арсенале врача имеются комбинированные средства, содержащие пирацетам и циннаризин. Назначают лекарство по 1-2 капсулы трижды в сутки. Курс терапии составляет 1-3 месяцев. Также используют производные гамма-аминомасляной кислоты (пикамелон). Он обладает сосудорасширяющим и ноотропным действием. Другим аналогом ГАМК явояется нооклерин.
Препарат Семакс является аналогом АКТГ. Он улучшает энергетический обмен в нейронах, повышает устойчивость их к гипоксии и повреждению. Его закапывают в нос, откуда он всасывается в системный кровоток через сосуды слизистой оболочки. Продолжительность лечения составляет 5-14 дней. Также препарат используют для эндоназального электрофореза (Семакс вводят с анода)
Лечение первичной открытоугольной глаукомы ноотропами
Глаукома – заболевание, для которого характерны прогрессирующая оптическая нейропатия, патологические изменения полей зрения и гибель ГКС. Согласно IV изданию Европейского глаукомного руководства, глаукома остается ведущей причиной слепоты в европейских странах, причем значительное количество пациентов с глаукомой теряют зрение или имеют существенные нарушения состояния полей зрения на обоих глазах.
Снижение ВГД не приводит к стабилизации глаукомного процесса. Заболевание может продолжать развиваться, несмотря на тот факт, что уровень ВГД поддерживается в пределах нормальных значений. Контроль за состоянием пациента не должен ограничиваться тонометрическими показателями.
Основным механизмом, лежащим в основе прогрессирования глаукомного процесса даже при стабилизации уровня ВГД, считается апоптоз. Апоптоз – гибель клеток в результате активации заложенного в них механизма аутолиза или генетически обусловленная программа физиологической гибели клеток.
Этот процесс направлен на сохранение целостности организма и реализуется при помощи поддержания определенного соотношения численности клеток различных тканей и удаления генетически измененных клеток. Апоптоз обычно не сопровождается развитием воспаления, т. к. целостность клеточной мембраны не нарушается.
Такие физиологических процессы, как запрограммированное разрушение клеток во время эмбриогенеза, удаление некоторых клеток при избыточной пролиферации и т. д. также имеют в своей основе механизм апоптоза. Гибель клетки при апоптозе включает следующие этапы:
- «запуск программы» апоптоза;
- активация проапоптотических белков;
- запуск ферментного каскада каспаз;
- разрушение структуры или перестройка внутриклеточных органелл;
- распад клетки с формированием апоптотических телец;
- подготовка фрагментов клетки к фагоцитозу.
Что особенно важно, до определенной стадии апоптоз представляет собой обратимый процесс, что существенно отличает его от гибели клеток путем некроза. Пусковые и регуляторные механизмы начальной фазы апоптоза очень сложны. Эксайтоаминокислоты, вирусные белки или ионы Ca2+ могут выступать в качестве стимуляторов апоптоза.
Центральная роль в процессах апоптоза нервной клетки отводится митохондриям. Изменение проницаемости митохондриальных мембран при окислительном стрессе и других состояниях приводит к выбросу из митохондрий ионов кальция и активаторов апоптоза, что и определяет необратимость процесса гибели нейроцита.
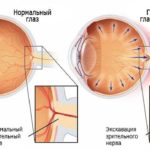
В эксперименте воздействие повышенного давления на культуру клеток аксонов зрительного нерва (ЗН) вследствие гипоксии в течение 3 дней приводило к делению и нарушению структуры митохондрий, что способствовало развитию апоптоза. Есть данные, свидетельствующие, что митохондриальная дисфункция может являться предрасполагающим фактором развития глаукомы.
При экспериментальном моделировании механического повреждения сетчатки, ишемического поражения в стекловидное тело поступает в избыточном количестве медиатор L-глутамат. Увеличение его концентрации приводит к гиперпродукции NO и O2, которые в свою очередь стимулируют процессы интоксикации и гибели клеток.
При глаукоме снижается устойчивость нервных клеток к стимуляторам апоптоза — эксайтоаминокислотам, вирусным белкам или ионам Ca2+. В норме в глазу ежегодно погибает до 5 тыс. ганглиозных клеток, при глаукоме это количество может увеличиваться вдвое.
Наличие связи «повышение ВГД – гибель ГКС» у пациентов с глаукомой не вызывает сомнения, однако вопросы, касающиеся первичности повреждения области головки ЗН или сетчатки и направления развития дистрофических изменений, остаются вопросами для обсуждения.
Согласно данным исследований на экспериментальной модели глаукомы, существует корреляция между уровнем ВГД и степенью выраженности апоптотического процесса, а также получены результаты, свидетельствующие о локализации первичного поражения при глаукоме в клетках сетчатки.
Дальнейшие экспериментальные и клинические исследования позволили утверждать, что при первичной открытоугольной глаукоме (ПОУГ) имеется дегенеративный процесс, который захватывает не только сетчатку и ЗН, но и весь зрительный путь. В 1998 г. M. Schwatz и E. Yoles, исследовав структуру ЗН при глаукоме, выделили 4 степени изменения аксонов:
- безвозвратно погибшие;
- с признаками, соответствующими острой фазе дегенерации;
- с дистрофическими изменениями, вследствие которых при сохранении условий существования они могли погибнуть;
- аксоны, структура которых была полностью сохранена.
Таким образом, воздействие на звенья апоптотического процесса может позволить существенно замедлить прогрессирование глаукомы и развитие осложнений. Комплекс терапевтических мер, направленных на предотвращение, уменьшение, а в ряде случаев – и обратимость процессов гибели нейрональных клеток, получил название нейропротекции или нейропротекторной терапии.
Нейропротекторная терапия проводится с целью уменьшения явлений дистрофии в ганглиозных клетках и сохранения целостности структуры неизмененных элементов.
С учетом вовлеченности в патологический процесс не только ГКС, но и волокон ЗН нейрональные изменения скорее попадают под определение «глаукомная нейроретинопатия», а терапевтические подходы к лечению следует описывать как нейроретинопротекцию.
Прямые нейропротекторы непосредственно защищают нейроны сетчатки и волокна ЗН от факторов повреждения клеток, обусловленных развитием ишемии и увеличением концентрации продуктов перекисного окисления липидов (ПОЛ), свободных радикалов, ионов кальция.
Препараты нейропротекторного действия должны обладать следующими характеристиками: реализовывать свое действие при условии наличия специфических точек приложения в структурах сетчатки, проявлять нейропротекторную активность в отношении ганглионарных клеток, достигать сетчатки и стекловидного тела в достаточных концентрациях.
Данные об эффективности препаратов должны иметь высокий уровень доказательности. Препараты пептидной структуры в группе прямых нейропротекторов обращают на себя внимание выраженностью тканеспецифического действия.
Пептиды отличаются отсутствием токсичности, аллергенности, иммуногенности, канцерогенности и тератогенности, проявляют свой эффект как при монотерапии, так и в сочетании с другими методами лечения. К препаратам пептидной структуры, соответствующим вышеприведенным критериям, относят Ретиналамин.
Основные эффекты Ретиналамина – это предотвращение эксайтотоксичности и окислительного стресса за счет коррекции нарушений клеточного метаболизма.
Механизм действия препарата определяется его метаболической активностью: он улучшает обмен веществ в тканях глаза, внутриклеточный синтез белка и нормализует функции клеточных мембран, регулирует процессы ПОЛ, способствует оптимизации энергетических процессов.
На этом фоне нормализуется проницаемость сосудов, активируются репаративные процессы при заболеваниях и травмах сетчатки глаза. В 2006–2007 гг. на базе Института молекулярной генетики РАН проведены исследования влияния Ретиналамина in vitro на выживаемость нервных клеток и состояние культивируемых клеток сетчатки в условиях окислительного стресса.
Протективный эффект наблюдался как до возникновения окислительного стресса, так и после него, т. е. для препарата характерны и профилактический, и лечебный потенциал. В условиях экспериментальной модели Ретиналамин также усиливал активность мюллеровских клеток сетчатки, которые являются инактиваторами глутамата.
Изменения в ГКС наблюдались уже через 3 мес. после появления патологических изменений трабекулярной сети, что свидетельствует в пользу раннего начала нейропротекторной терапии.
В ряде клинических исследований назначение Ретиналамина приводило к достоверному увеличению средней толщины ретинальных нервных волокон, усилению активности мюллеровских клеток, объективному улучшению центрального зрения, уменьшению количества и глубины скотом.
С учетом того факта, что признаки апоптоза выявляются на самых начальных этапах глаукомы, отдельного внимания заслуживает оценка эффективности Ретиналамина при I и II стадиях заболевания.
На базе кафедры офтальмологии лечебного факультета РГМУ в 2005 и 2008 гг. проведено 2 исследования, посвященных определению терапевтической эффективности Ретиналамина у больных с компенсированной ПОУГ. В каждое исследование было включено по 90 пациентов с ПОУГ, которых распределили на 2 группы: 1-ю – основную (Ретиналамин) и 2-ю – контрольную (плацебо).
Отличие состояло в способе введения препарата (в 1-м исследовании Ретиналамин применялся парабульбарно, во 2-м – в/м) и продолжительности терапии (в 1-м исследовании выполнялось 10 инъекций Ретиналамина, во 2-м – 2 курса по 10 инъекций с перерывом 3 мес.).
Применение Ретиналамина у больных глаукомой приводит к улучшению субъективных и объективных функций зрительного анализатора. Положительная динамика критической частоты слияния мельканий была выявлена у 76,4% больных (р<0,05). Положительная динамика электрофизиологических показателей была выявлена у 84,7% пациентов.
Эффект нарастал постепенно, и через 1 мес. после завершения терапии состояние основных показателей превышало показатели, выявленные непосредственно после окончания курса лечения. После 2-го курса терапии отмечалось увеличение эффекта препарата.
В 2007 г. группой исследователей были опубликованы результаты применения Ретиналамина при всех стадиях ПОУГ, включая начальную. В исследование были включены пациенты c I, II и III стадиями ПОУГ, имевшие нормальное ВГД после лазерной трабекулопластики или других хирургических операций.
Ретиналамин назначали в виде парабульбарных инъекций ежедневно по 5 мг. Повторные исследования проводили на 10-й день применения препарата. Проводили вакуум-компрессионный тест с записью зрительно вызванных корковых потенциалов и сканирующую лазерную ретинальную томографию.
У пациентов с III стадией прослеживалось улучшение изученных показателей полей зрения и остроты зрения от начала лечения. Отмечались положительная динамика электрофизиологических показателей и увеличение толерантности ЗН к повышенной нагрузке на начальной, развитой и далеко зашедшей стадиях глаукомы.
Также в 2007 г. было проведено другое исследование с участием 120 больных ПОУГ. Все пациенты с ПОУГ I–III стадий были разделены на 3 группы по 40 человек. 1-я группа получала Ретиналамин парабульбарно 10 дней 1 р./год, пациентам 2-й группы препарат вводили однократно в субтеноново пространство 1 р./год, в 3-й группе назначался препарат Кортексин однократно в субтеноново пространство 1 р./год.
Стандартное офтальмологическое обследование, исследование контрастной чувствительности проводили через 10 дней, а также через 3, 6, 12, 18, 24, 36 мес.
Начиная с 3 мес. после лечения наблюдалась положительная динамика исследуемых показателей в группах, получавших Ретиналамин, более выраженная – при начальной и развитой стадиях заболевания по сравнению с результатами лечения у пациентов с далеко зашедшей стадией и в группе, получавшей Кортексин.
В исследование 2013 г. включили 96 пациентов (192 глаза) в возрасте от 50 до 70 лет с I, II стадиями глаукомы и нормализованным ВГД. Они были разделены на 2 группы. Пациенты 1-й (основной) группы (70 человек, 140 глаз) получали Ретиналамин и стандартную системную терапию, пациенты 2-й (контрольной) группы (26 человек, 52 глаза) – только системную терапию.
Обследование, включающее визометрию, рефрактометрию, компьютерную статическую периметрию, тонометрию, офтальмоскопию глазного дна, лазерную сканирующую конфокальную ретинотомограмму, проводили через 1, 3, 6, 12, 18, 24 и 30 мес. Клинически значимые результаты после применения Ретиналамина были отмечены через 3, 6, 12 мес.
Отмечались расширение границ поля зрения, увеличение остроты зрения, средней толщины ретинальных нервных волокон, стабилизация глаукомного процесса по данным офтальмоскопии. В контрольной группе к концу периода наблюдения у большинства пациентов отмечали прогрессирование течения ПОУГ.
Для получения дополнительных данных об эффективности препарата Ретиналамин при в/м введении в период с ноября 2013 по май 2014 г. было проведено всероссийское скрининговое исследование эффективности применения Ретиналамина у пациентов с компенсированной ПОУГ.
В исследование было включено 453 пациента (453 глаза) в возрасте от 28 до 89 лет, средний возраст больных составил 66,4±0,5 года. У основного количества пациентов (199 глаз, 43,9% и 209 глаз, 46,1%) был поставлен диагноз ПОУГ I и II стадий. Наименьшее количество включенных в исследование пациентов было с диагнозом ПОУГ III стадии (45 глаз, 9,9%).
Оценивали эффективность 10-дневного курса лечения Ретиналамином при в/м введении у пациентов с компенсированной ПОУГ в амбулаторной практике. В исследование включали пациентов с ПОУГ I–III стадий с компенсированным уровнем ВГД. Ретиналамин вводился всем пациентам по 5 мг в/м в течение 10 дней.
Общий период наблюдения составил 3 мес. В течение этого времени протоколом было предусмотрено 4 контрольных осмотра пациентов: до лечения, через 10 дней после его начала, через 1 и 3 мес.
Проводилось комплексное обследование пациента, включавшее оценку остроты зрения, тонометрию по методу Маклакова с последующим пересчетом значений тонометрического ВГД в истинное, периметрию на аппарате «Периком» с оценкой полей зрения по 8 меридианам и суммы показателей полей зрения по 8 меридианам и офтальмоскопию с оценкой диаметра экскавации диска ЗН.
Было установлено, что применение препарата Ретиналамин при ПОУГ в течение 10 дней в/м обеспечивает:
- увеличение остроты зрения на всех сроках наблюдения;
- снижение показателей ВГД на всех сроках наблюдения в рамках нормальных значений;
- расширение границ поля зрения через 1 и 3 мес. после 10-дневного курса лечения;
- стабилизацию изученных показателей на всех стадиях глаукомы;
- улучшение показателей (острота зрения, поле зрения, ВГД) после курса Ретиналамина) происходит в течение 3-х мес.;
- наибольшая эффективность нейропротекторной терапии была зафиксирована у пациентов с I и II стадиями ПОУГ.
В настоящее время все больше данных подтверждают тот факт, что глаукомный процесс сопровождается значительной потерей ГКС. Это обусловлено не только повышением уровня ВГД, но и целым рядом патологических механизмов, включающих нарушение ауторегуляции, глутамат-индуцированную эксайтотоксичность, развитие ишемии, нарушение метаболизма кальция, окислительный стресс и пр.
Согласно результатам морфологических и клинических исследований, патологические изменения затрагивают ГКС на самых ранних сроках заболевания глаукомой.
Назначение препарата пептидной структуры Ретиналамина характеризуется выраженным положительным действием на клеточные элементы сетчатки, что проявляется увеличением остроты зрения, улучшением состояния полей зрения и электрофизиологических показателей.
Наиболее значимый эффект отмечается при назначении Ретиналамина пациентам с I и II стадиями ПОУГ. Дальнейшее изучение возможностей нейропротекторной терапии позволит выявить новые инструменты для предупреждения прогрессирования глаукомы.
Вторичная нейропротекция при глаукоме
Долгие годы гипотензивное лечение глаукомы являлось основной терапевтической стратегией. Однако в последнее время в связи с изменившимися представлениями о сути заболевания и его патогенезе все большее значение приобретает нейропротекторная терапия глаукомы, которая в ближайшие годы может стать основополагающим методом в лечении этого тяжелого заболевания.
В связи с нейропротекцией принято различать как прямое нейропротекторное действие того или иного ЛС, так и его опосредованное действие (Levin L., 1999). В свою очередь, прямые нейропротекторы подразделяются на первичные и вторичные.
Прямым нейропротекторным эффектом обладают первичные нейропротекторы, действие которых направлено на прерывание самых ранних процессов ишемического каскада: препараты, блокирующие NMDA-рецепторы – ремацемид, магнезия, лубелузол, глицин, элипродил, флюпиртин, мемантин и антагонисты потенциал-зависимых кальциевых каналов.
Вторичные нейропротекторы также обладают прямым нейропротекторным действием, однако их действие направлено на прерывание отсроченных механизмов гибели нейронов.
Учитывая тот факт, что нейропротекторное лечение глаукомной оптиконейропатии (ГОН) должно носить курсовой характер и назначаться больному глаукомой постоянно, для лечения ГОН более показаны препараты, не имеющие противопоказаний и способные действовать превентивно.
В этом аспекте предпочтительнее средства, относящиеся к вторичным нейропротекторам. Из них наиболее перспективно использование пептидных биорегуляторов, антиоксидантов и нейропептидов.
Применение пептидных биорегуляторов в лечении ГОН

Цитомедины влияют на клеточный и гуморальный иммунитет, ПОЛ, повышают защитные реакции организма независимо от того, из каких органов и тканей они были получены. Цитомедины, получаемые из тканей головного мозга и сетчатки, обладают функцией нейропептидов, они активно участвуют в регуляции деятельности нервной ткани.
В настоящее время в офтальмологии широкое распространение нашли такие отечественные препараты, как ретиналамин и кортексин. Кортексин представляет собой комплекс пептидов, выделенных из коры головного мозга крупного рогатого скота и свиней.
Кортексин обладает тропным действием в отношении коры головного мозга и регулирует процессы метаболизма в коре головного мозга, зрительном нерве и нейронах сетчатки. Эффективность препарата в лечении ГОН, особенно при его применении в виде эндоназального электрофореза, была продемонстрирована в недавней работе Л.А.Сухаревой и соавт. (2008).
Опыт отечественной медицины в этом направлении представлены сотнями работ, выполненными в последние годы. Ретиналамин выделен из сетчатки крупного рогатого скота. Он уменьшает деструктивные процессы в пигментном эпителии сетчатки, улучшает функциональное взаимодействие пигментного эпителия и наружных сегментов фоторецепторов.
В настоящее время уже исследованы свойства ретиналамина в эксперименте и показана его эффективность при таких заболеваниях, как диабетическая ретинопатия, тромбоз вен сетчатки, пигментная абиотрофия, инволюционная центральная дистрофия.
В 2002 г. на базе кафедры офтальмологии РГМУ Москвы совместно с ООО “Герофарм” С.-Петербург проведены исследования и опубликованы результаты терапевтической эффективности препарата ретиналамин у больных глаукомой с компенсированным офтальмотонусом (Налобнова Ю.В. и соавт., 2003, 2004).
Сотрудниками отдела глаукомы МНИИ ГБ им.Гельмгольца было проведено сравнительное изучение эффективности пептидных биорегуляторов в лечении больных ПОУГ (Еричев В.П. и др. 2005). Авторы пришли к заключению, что наиболее эффективным можно считать внутримышечное и местное введение ретиналамина и внутримышечное введение кортексина.
Следует отметить, что улучшение показателей светочувствительности сетчатки и контрастной чувствительности наблюдалось порой лишь через 3 месяца после окончания курса лечения, и в основном у больных с начальной и развитой стадиями глаукомы.
Т.В.Ставицкая и Е.А.Егоров (2004) выполнили сравнительное исследование рассмотренных выше нейропротекторов в условиях экспериментальной пролонгированной ишемии. Авторы провели электрофизиологические исследования (запись ЭРГ и зрительных вызванных потенциалов мозга) на фоне лечения экспериментальных животных бетаксололом, эмоксипином, гистохромом, цитохромом С и ретиналамином.
Кроме того, был выполнен морфологический анализ сетчатки экспериментальных животных, включавший изучение ганглиозных нейронов. В результате обнаружена высокая нейропротекторная активность бетаксолола, ретиналамина и эмоксипина.
Примечательно, что на фоне лечения ретиналамином отмечался повторный пик увеличения электрофизиологических параметров при новом введении ретиналамина в сроки, превышающие среднее время удержания препарата в сетчатке, что обусловлено активацией собственных защитных механизмов сетчатки на фоне применения ретиналамина.
Применение антиоксидантов в лечении ГОН
Для коррекции метаболизма используют атиоксиданты (эмоксипин, мексидол, аскорбиновую кислоту, гистохром, витамин Е, рутин, препараты на основе супероксиддисмутазы, кверцетин).
Антиоксидантными свойствами обладает лютеин-комплекс. Благодаря входящим в состав препарата флавоноидам, витамину А, бета-каротину, цинку и меди, препарат улучшает микроциркуляцию в сетчатке, а также тканевой метаболизм и способствует регенерации поврежденных тканей.
Применение лютеин-комплекса по 1 таб. 2 раза в день в течение 2 месяцев показало эффективность данного препарата в лечении ГОН (Мошетова Л.К., 2005).
Применение препаратов, ингибирующих апоптоз
Установление контроля за процессами апоптоза является одной из важнейших стратегических задач нейропротекции (T.Koike, 1991). Сейчас начата разработка методов антиапоптотической защиты нейронов в условиях ишемии.
Проблема медикаментозного подавления апоптоза связана с тем, что сам по себе апоптоз представляет собой в физиологическом смысле очень значимый механизм. При нарушении баланса проапоптотических и антиапоптотических факторов происходят срывы, приводящие к развитию тяжелых раковых или дегенеративных заболеваний.
Предотвращая апоптоз ганглиозных клеток сетчатки, мы рискуем вызвать раковые заболевания. Это можно проиллюстрировать обсуждаемым в литературе назначением антиапоптотического агента bcl2, который одновременно является канцерогеном (A.Bron, 2000).
На основании достижений современных молекулярно-генетических исследований проводится лабораторный синтез аналогов эндогенных нейротрофинов, выключающих механизмы “программированной” клеточной смерти. Безусловно, результаты этого научного поиска представляют огромный интерес и, возможно, определят терапевтические стратегии будущего.
Применение ингибиторов NO-синтазы в лечении ГОН
Высвобождение оксида азота и образование пероксинитрита может быть ингибировано блокаторами синтазы оксида азота (NOS). Применение селективного блокатора нейрональной NO-синтазы 7-нитрониндазол и 1-(2-флюорометилфенил) — имидазола подтвердило эффективность данного лечения в клинике ишемических поражений мозга.
Относительно селективная (избирательная) блокада индуцибельной NO-синтазы (iNOS) аминогуанидинами также оказывает мощное нейропротекторное действие. Данный препарат предложен в качестве нейропротектора в лечении ГОН A.Neufeld в 2004 г.
С позиций признаваемой в настоящее время важной роли NO в патогенезе ГОН указанное направление нейропротекторного лечения глаукомы представляется перспективным, однако требует уточнения, поскольку уровень продукции оксида азота изменяется по мере прогрессирования заболевания (Курышева Н.И. и соавт., 2001).
Применение средств, улучшающих нейротрофическое обеспечение нервной ткани
Важную роль в функционировании нервной ткани играют нейропептиды. Работают нейропептиды лишь “в нужном месте” и “в нужное время” и затем быстро исчезают. Эндогенное образование нейропептида в ответ на какое-либо изменение внутренней среды приводит к высвобождению ряда других пептидов, для которых первый является индуктором.
Это усиливает и пролонгирует действие нейропептидов. Примерами препаратов этой группы являются церебролизин, семакс, который способен регулировать экспрессию нейротрофинов 3,4,5 и BDNF и положительно зарекомендовал себя в лечении ГОН.
К вторичным нейропротекторам относятся также средства, улучшающие глазную гемодинамику (аспирин, курантил, тиклид, трентал и др.), в т.ч. и антагонисты ренин-ангиотензивной системы рамиприл, каптоприл, которые улучшают поля зрения больных глаукомой и снижают ВГД при пероральном приеме препарата.
Полиморфизмом эффектов обладает гинкго билоба, который является ловушкой для свободных радикалов, включая оксид азота, а также ингибирует его продукцию, снижает вазоспазм церебральных сосудов, защищает фоторецепторы и ганглиозные клетки сетчатки (ГКС) от повреждения светом, а также подавляя токсическое действие глутамата.
Препарат улучшает регионарный кровоток в ишемизированных тканях и снижает проницаемость капиллярной стенки. К настоящему времени доказана эффективность лечения данным препаратом больных глаукомой. Для достижения терапевтического эффекта прием гинкго билоба должен осуществляться длительно (не менее 3 месяцев).
Иммунологические аспекты лечения ГОН
В настоящее время накоплены данные об иммунных механизмах глаукомного поражения, а также о роли нейроглии в этих механизмах. Bakalash S. (2003) было предложено использовать с нейропртекторной целью своеобразную вакцинацию, при которой антигеном выступает сама нейроглия, а образующиеся при этом антитела защищают ганглиозные клетки от патологических глиальных эффектов.
Недавно установлено, что за апоптоз ГКС ответственен некий белок амилоид-бета, и в этом плане глаукома сродни болезни Альцгеймера. На модели экспериментальной глаукомы было показано, что применение антител к данному белку может существенно уменьшить апоптоз ГКС.
В литературе обсуждается возможность применения при глаукоме и других нейропротекторов, таких как каннабиноиды, ганглиозиды, статины. Применение последних может быть эффективным для снижения риска развития глаукомы, особенно у лиц, страдающих атеросклерозом.
Большинство вторичных нейропротекторов обладают также и репаративными свойствами. Все нейротрофические факторы, модуляторы состояния мембран и рецепторов (ганглиозиды), эндогенные регуляторы (нейропептиды) оказывают мощное влияние на течение восстановительных процессов в нервной ткани.
В то же время “преимущественно репаративные” средства могут оказывать и некоторое нейропротекторное действие. К препаратам репаративного действия относят ноотропы – пирацетам, пикамилон, цитиколин. Пожалуй, самым последним и наиболее перспективным направлением развития исследований в области нейропротекции следует считать применение нанотехнологий.
Это касается как трансплантации стволовых клеток и применения нановолокон, обеспечивающих регенерацию поврежденных аксонов, так и модулирования работы ионных каналов, расположенных на мембранах нейронов.
В заключение можно отметить, что современное понимание тонких механизмов развития глаукомной оптиконейропатии и богатый опыт применения нейропротекторов при неврологических заболеваниях со сходным патогенезом открывают широкие перспективы в научном поиске новых путей нейропротекторного лечения ГОН.
Успехи, уже достигнутые в этом направлении, позволяют надеяться, что нейропротекция займет достойное место в повседневном лечении первичной глаукомы.
Источники: remedium.ru, vse-zabolevaniya.ru, umedp.ru, aprilpublish.ru, health-ua.com, vetacademy.ru



Комментарии: